Modern tıp alanında antibiyotikler, mikrobiyal enfeksiyonlarla ilişkili görülme ve ölüm oranlarını önemli ölçüde düşürerek en önemli gelişmelerden biri olduğunu kanıtlamıştır. Bakteriyel enfeksiyonların klinik sonuçlarını değiştirme yetenekleri, sayısız hastanın yaşam beklentisini uzatmıştır. Antibiyotikler, ameliyatlar, implant yerleştirme, organ nakli ve kemoterapi dahil olmak üzere karmaşık tıbbi prosedürlerde kritik öneme sahiptir. Bununla birlikte, antibiyotik dirençli patojenlerin ortaya çıkması giderek artan bir endişe kaynağı olmuş ve bu ilaçların etkinliğini zamanla azaltmıştır. Mikrobiyal mutasyonlar meydana geldikçe, antibiyotik direncine dair örnekler tüm antibiyotik kategorilerinde belgelenmiştir. Antimikrobiyal ilaçların uyguladığı seçilim baskısı, dirençli suşların ortaya çıkmasına katkıda bulunmuş ve küresel sağlık için önemli bir zorluk oluşturmuştur.
Antibiyotik direnci sorununa karşı mücadele etmek için, dirençli patojenlerin yayılmasını kısıtlayan etkili enfeksiyon kontrol politikalarının uygulanması ve antibiyotik kullanımının azaltılması şarttır. Ayrıca, alternatif tedavi yöntemlerine de acil ihtiyaç duyulmaktadır. Hiperbarik Oksijen Tedavisi (HBOT), bu bağlamda umut vadeden bir yöntem olarak ortaya çıkmıştır ve belirli bir süre boyunca belirli basınç seviyelerinde %100 oksijen solunmasını içerir. Enfeksiyonlar için birincil veya tamamlayıcı bir tedavi olarak konumlandırılan HBOT, antibiyotik dirençli patojenlerin neden olduğu akut enfeksiyonların tedavisinde yeni bir umut sunabilir.
Bu terapi, iltihaplanma, karbonmonoksit zehirlenmesi, kronik yaralar, iskemik hastalıklar ve enfeksiyonlar dahil olmak üzere çeşitli durumlar için birincil veya alternatif tedavi olarak giderek daha fazla uygulanmaktadır. Hiperbarik oksijen tedavisinin enfeksiyon tedavisindeki klinik uygulamaları oldukça kapsamlı olup hastalara paha biçilmez avantajlar sağlamaktadır.

Hiperbarik Oksijen Tedavisinin Enfeksiyonlardaki Klinik Uygulamaları
Mevcut kanıtlar, hiperbarik oksijen tedavisinin (HBOT) hem tek başına hem de yardımcı bir tedavi olarak uygulanmasını güçlü bir şekilde desteklemekte ve enfekte hastalara önemli faydalar sağlamaktadır. HBOT sırasında, arteriyel kan oksijen basıncı 2000 mmHg'ye kadar yükselebilir ve bunun sonucunda oluşan yüksek oksijen-doku basıncı gradyanı, doku oksijen seviyelerini 500 mmHg'ye kadar çıkarabilir. Bu etkiler, iskemik ortamlarda gözlemlenen inflamatuar yanıtların ve mikrosirkülasyon bozukluklarının iyileşmesini desteklemede ve kompartman sendromunu yönetmede özellikle değerlidir.
Hiperbarik oksijen tedavisi (HBOT), bağışıklık sistemine bağlı rahatsızlıkları da etkileyebilir. Araştırmalar, HBOT'nin otoimmün sendromları ve antijen kaynaklı bağışıklık tepkilerini baskılayarak, lenfosit ve lökosit dolaşımını azaltıp bağışıklık tepkilerini düzenleyerek greft toleransının korunmasına yardımcı olabileceğini göstermektedir. Ayrıca, HBOTiyileşmeyi desteklerKronik cilt lezyonlarında anjiyogenezi uyararak iyileşme için kritik bir süreç sağlar. Bu terapi aynı zamanda yara iyileşmesinde önemli bir aşama olan kolajen matrisinin oluşumunu da teşvik eder.
Özellikle nekrotizan fasiit, osteomiyelit, kronik yumuşak doku enfeksiyonları ve enfeksiyöz endokardit gibi derin ve tedavisi zor enfeksiyonlara özel dikkat gösterilmelidir. Hiperbarik oksijen tedavisinin en yaygın klinik uygulamalarından biri, genellikle anaerobik veya dirençli bakterilerin neden olduğu düşük oksijen seviyeleriyle ilişkili deri-yumuşak doku enfeksiyonları ve osteomiyelittir.
1. Diyabetik Ayak Enfeksiyonları
Diyabetik ayakÜlserler, diyabet hastalarında yaygın bir komplikasyondur ve bu popülasyonun %25'ine kadarını etkiler. Bu ülserlerde sıklıkla enfeksiyonlar ortaya çıkar (vakaların %40-80'ini oluşturur) ve morbidite ve mortaliteyi artırır. Diyabetik ayak enfeksiyonları (DKİ), genellikle çeşitli anaerobik bakteri patojenlerinin tanımlandığı polimikrobiyal enfeksiyonlardan oluşur. Fibroblast fonksiyon bozuklukları, kolajen oluşumu sorunları, hücresel bağışıklık mekanizmaları ve fagosit fonksiyonu dahil olmak üzere çeşitli faktörler, diyabet hastalarında yara iyileşmesini engelleyebilir. Birçok çalışma, bozulmuş cilt oksijenlenmesini DKİ'lerle ilişkili amputasyonlar için güçlü bir risk faktörü olarak tanımlamıştır.
DFI tedavisi için mevcut seçeneklerden biri olarakHiperbarik oksijen tedavisi (HBOT), diyabetik ayak ülserlerinin iyileşme oranlarını önemli ölçüde artırdığı ve dolayısıyla amputasyon ve karmaşık cerrahi müdahalelere olan ihtiyacı azalttığı bildirilmiştir. Sadece flep ameliyatları ve deri grefti gibi kaynak yoğun prosedürlere olan ihtiyacı en aza indirmekle kalmaz, aynı zamanda cerrahi seçeneklere kıyasla daha düşük maliyetler ve minimum yan etkiler sunar. Chen ve ark. tarafından yapılan bir çalışma, 10'dan fazla HBOT seansının diyabetik hastalarda yara iyileşme oranlarında %78,3'lük bir iyileşmeye yol açtığını göstermiştir.
2. Nekrotizan Yumuşak Doku Enfeksiyonları
Nekrotizan yumuşak doku enfeksiyonları (NSTI'ler) genellikle polimikrobiyaldir, tipik olarak aerobik ve anaerobik bakteriyel patojenlerin bir kombinasyonundan kaynaklanır ve sıklıkla gaz üretimiyle ilişkilidir. NSTI'ler nispeten nadir olmakla birlikte, hızlı ilerlemeleri nedeniyle yüksek bir ölüm oranına sahiptirler. Olumlu sonuçlar elde etmek için zamanında ve uygun tanı ve tedavi çok önemlidir ve hiperbarik oksijen tedavisi (HBOT), NSTI'lerin yönetiminde yardımcı bir yöntem olarak önerilmiştir. Prospektif kontrollü çalışmaların eksikliği nedeniyle HBOT'nin NSTI'lerde kullanımı konusunda tartışmalar devam etse de,Elde edilen kanıtlar, bunun NSTI hastalarında hayatta kalma oranlarının artması ve organların korunmasıyla ilişkili olabileceğini düşündürmektedir.Geriye dönük bir çalışma, hiperbarik oksijen tedavisi (HBOT) alan NSTI hastalarında ölüm oranlarında önemli bir azalma olduğunu göstermiştir.
1.3 Cerrahi Bölge Enfeksiyonları
Cerrahi alan enfeksiyonları (SSI'lar), enfeksiyonun anatomik bölgesine göre sınıflandırılabilir ve hem aerobik hem de anaerobik bakteriler dahil olmak üzere çeşitli patojenlerden kaynaklanabilir. Sterilizasyon teknikleri, profilaktik antibiyotik kullanımı ve cerrahi uygulamalardaki iyileştirmeler gibi enfeksiyon kontrol önlemlerindeki gelişmelerine rağmen, SSI'lar kalıcı bir komplikasyon olmaya devam etmektedir.
Önemli bir inceleme, nöromüsküler skolyoz ameliyatlarında derin cerrahi alan enfeksiyonlarını (SSI) önlemede hiperbarik oksijen tedavisinin (HBOT) etkinliğini araştırmıştır. Ameliyat öncesi HBOT, SSI insidansını önemli ölçüde azaltabilir ve yara iyileşmesini kolaylaştırabilir. Bu invaziv olmayan terapi, yara dokularında oksijen seviyelerinin yükseldiği bir ortam yaratır; bu da patojenlere karşı oksidatif öldürme etkisiyle ilişkilendirilmiştir. Ek olarak, SSI gelişimine katkıda bulunan düşük kan ve oksijen seviyelerini de ele alır. Diğer enfeksiyon kontrol stratejilerinin ötesinde, HBOT özellikle kolorektal işlemler gibi temiz-kontamine ameliyatlar için önerilmiştir.
1.4 Yanıklar
Yanıklar, aşırı ısı, elektrik akımı, kimyasallar veya radyasyondan kaynaklanan yaralanmalardır ve yüksek morbidite ve mortalite oranlarına neden olabilirler. Hiperbarik oksijen tedavisi (HBOT), hasarlı dokulardaki oksijen seviyelerini artırarak yanıkların tedavisinde faydalıdır. Hayvan ve klinik çalışmalar, bu konuda karışık sonuçlar ortaya koymaktadır.Hiperbarik oksijen tedavisinin yanık tedavisindeki etkinliği125 yanık hastasının katıldığı bir çalışmada, hiperbarik oksijen tedavisinin (HBOT) ölüm oranları veya yapılan ameliyat sayısı üzerinde anlamlı bir etkisi olmadığı, ancak ortalama iyileşme süresini kısalttığı (43,8 güne kıyasla 19,7 gün) gösterilmiştir. HBOT'nin kapsamlı yanık yönetimiyle entegre edilmesi, yanık hastalarında sepsisi etkili bir şekilde kontrol ederek daha kısa iyileşme sürelerine ve daha düşük sıvı ihtiyacına yol açabilir. Bununla birlikte, yaygın yanıkların yönetiminde HBOT'nin rolünü doğrulamak için daha kapsamlı prospektif araştırmalara ihtiyaç duyulmaktadır.
1.5 Osteomiyelit
Osteomiyelit, genellikle bakteriyel patojenlerin neden olduğu kemik veya kemik iliği enfeksiyonudur. Kemiklere nispeten zayıf kan akışı ve antibiyotiklerin kemik iliğine sınırlı nüfuzu nedeniyle osteomiyelit tedavisi zor olabilir. Kronik osteomiyelit, kalıcı patojenler, hafif iltihaplanma ve nekrotik kemik dokusu oluşumu ile karakterize edilir. Dirençli osteomiyelit ise uygun tedaviye rağmen devam eden veya tekrarlayan kronik kemik enfeksiyonlarını ifade eder.
Hiperbarik oksijen tedavisi (HBOT), enfekte kemik dokularındaki oksijen seviyelerini önemli ölçüde iyileştirdiği gösterilmiştir. Çok sayıda vaka serisi ve kohort çalışması, HBOT'nin osteomiyelit hastalarında klinik sonuçları iyileştirdiğini göstermektedir. Metabolik aktiviteyi artırma, bakteriyel patojenleri baskılama, antibiyotik etkilerini artırma, iltihabı en aza indirme ve iyileşmeyi teşvik etme gibi çeşitli mekanizmalar yoluyla çalıştığı görülmektedir.Hiperbarik oksijen tedavisi (HBOT) sonrasında, kronik ve dirençli osteomiyelitli hastaların %60 ila %85'inde enfeksiyon baskılanması belirtileri görülür.
1.6 Mantar Enfeksiyonları
Dünya genelinde üç milyondan fazla kişi kronik veya invaziv mantar enfeksiyonlarından muzdarip olup, bu durum yılda 600.000'den fazla ölüme yol açmaktadır. Mantar enfeksiyonlarının tedavi sonuçları, bağışıklık sisteminin değişmesi, altta yatan hastalıklar ve patojenin virülans özellikleri gibi faktörler nedeniyle sıklıkla olumsuz etkilenmektedir. Hiperbarik oksijen tedavisi (HBOT), güvenliği ve invaziv olmaması nedeniyle şiddetli mantar enfeksiyonlarında cazip bir tedavi seçeneği haline gelmektedir. Çalışmalar, HBOT'nin Aspergillus ve Mycobacterium tuberculosis gibi mantar patojenlerine karşı etkili olabileceğini göstermektedir.
Hiperbarik oksijen tedavisi (HBOT), Aspergillus'un biyofilm oluşumunu engelleyerek antifungal etkiler gösterir ve süperoksit dismutaz (SOD) genlerinden yoksun suşlarda etkinliğin arttığı gözlemlenmiştir. Mantar enfeksiyonları sırasında oluşan hipoksik koşullar, antifungal ilaçların verilmesinde zorluklar yaratır; bu nedenle HBOT'tan kaynaklanan artan oksijen seviyeleri potansiyel olarak faydalı bir müdahale olabilir, ancak daha fazla araştırmaya ihtiyaç vardır.
Hiperbarik Oksijen Tedavisinin Antimikrobiyal Özellikleri
Hiperbarik oksijen tedavisi (HBOT) ile oluşturulan hiperoksik ortam, antibakteriyel özellikleri uyaran fizyolojik ve biyokimyasal değişiklikleri başlatarak enfeksiyon için etkili bir yardımcı tedavi yöntemi haline gelir. HBOT, doğrudan bakterisidal aktivite, bağışıklık tepkilerinin güçlendirilmesi ve belirli antimikrobiyal ajanlarla sinerjik etkiler gibi mekanizmalar yoluyla aerobik bakterilere ve ağırlıklı olarak anaerobik bakterilere karşı dikkat çekici etkiler göstermektedir.
2.1 Hiperbarik Oksijen Tedavisinin Doğrudan Antibakteriyel Etkileri
Hiperbarik oksijen tedavisinin doğrudan antibakteriyel etkisi büyük ölçüde, süperoksit anyonları, hidrojen peroksit, hidroksil radikalleri ve hidroksil iyonları gibi reaktif oksijen türlerinin (ROS) oluşumuna atfedilir; bunların hepsi hücresel metabolizma sırasında ortaya çıkar.
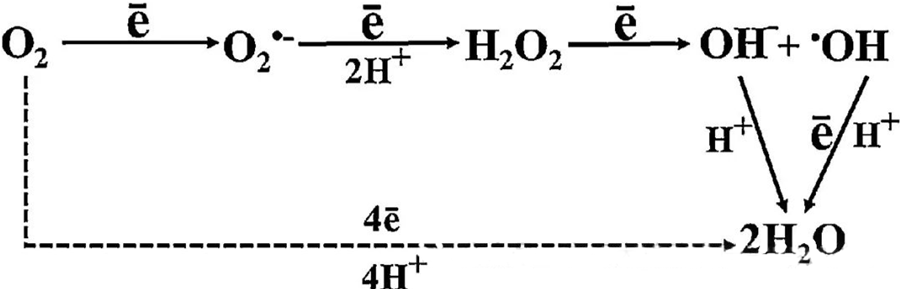
O₂ ile hücresel bileşenler arasındaki etkileşim, hücrelerde ROS'un nasıl oluştuğunu anlamak için çok önemlidir. Oksidatif stres olarak adlandırılan belirli koşullar altında, ROS oluşumu ve bozunması arasındaki denge bozulur ve hücrelerde ROS seviyeleri yükselir. Süperoksit (O₂⁻) üretimi, süperoksit dismutaz tarafından katalize edilir ve bu da O₂⁻'ü hidrojen peroksite (H₂O₂) dönüştürür. Bu dönüşüm, Fe²⁺'yi oksitleyerek hidroksil radikalleri (·OH) ve Fe³⁺ üreten Fenton reaksiyonu ile daha da güçlendirilir ve böylece ROS oluşumu ve hücresel hasarın zararlı bir redoks dizisi başlatılır.
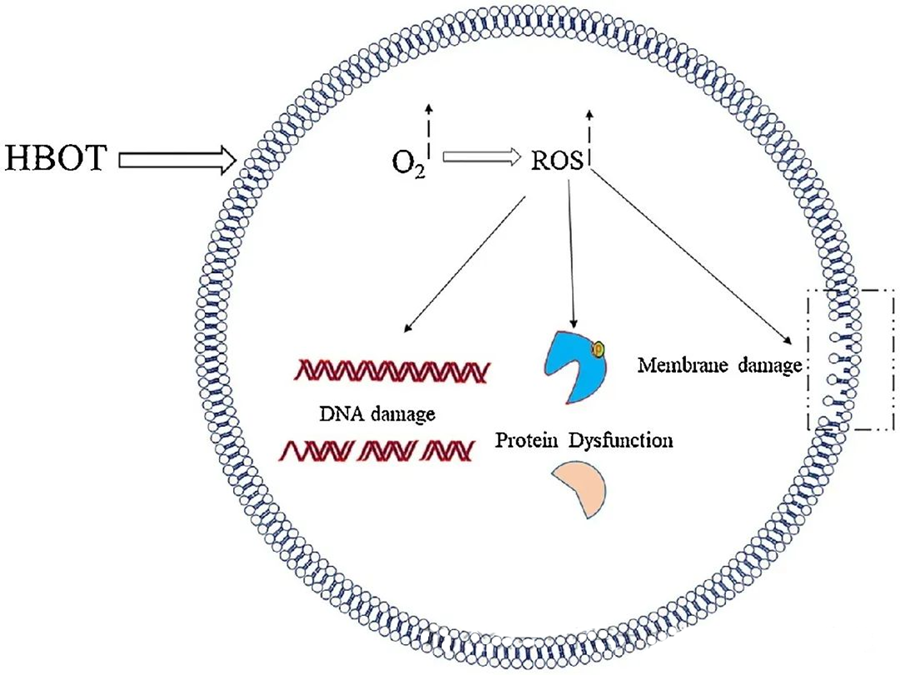
Reaktif oksijen türlerinin (ROS) toksik etkileri, DNA, RNA, proteinler ve lipitler gibi kritik hücresel bileşenleri hedef alır. Özellikle DNA, deoksiriboz yapılarını bozduğu ve baz bileşimlerine zarar verdiği için H₂O₂ aracılı sitotoksisitenin birincil hedefidir. ROS'un neden olduğu fiziksel hasar, DNA'nın sarmal yapısına kadar uzanır ve muhtemelen ROS tarafından tetiklenen lipit peroksidasyonundan kaynaklanır. Bu, biyolojik sistemlerde yüksek ROS seviyelerinin olumsuz sonuçlarının altını çizmektedir.
ROS'un Antimikrobiyal Etkisi
ROS, HBOT kaynaklı ROS oluşumuyla gösterildiği gibi, mikrobiyal büyümenin engellenmesinde hayati bir rol oynar. ROS'un toksik etkileri, DNA, proteinler ve lipitler gibi hücresel bileşenleri doğrudan hedef alır. Yüksek konsantrasyonlardaki aktif oksijen türleri, lipitlere doğrudan zarar vererek lipit peroksidasyonuna yol açabilir. Bu süreç, hücre zarlarının bütünlüğünü ve dolayısıyla zarla ilişkili reseptörlerin ve proteinlerin işlevselliğini tehlikeye atar.
Ayrıca, ROS'un önemli moleküler hedefleri olan proteinler, sistein, metiyonin, tirozin, fenilalanin ve triptofan gibi çeşitli amino asit kalıntılarında spesifik oksidatif modifikasyonlara uğrarlar. Örneğin, HBOT'nin E. coli'deki uzama faktörü G ve DnaK dahil olmak üzere çeşitli proteinlerde oksidatif değişikliklere neden olduğu ve böylece hücresel işlevlerini etkilediği gösterilmiştir.
Hiperbarik Oksijen Tedavisi ile Bağışıklığı Güçlendirme
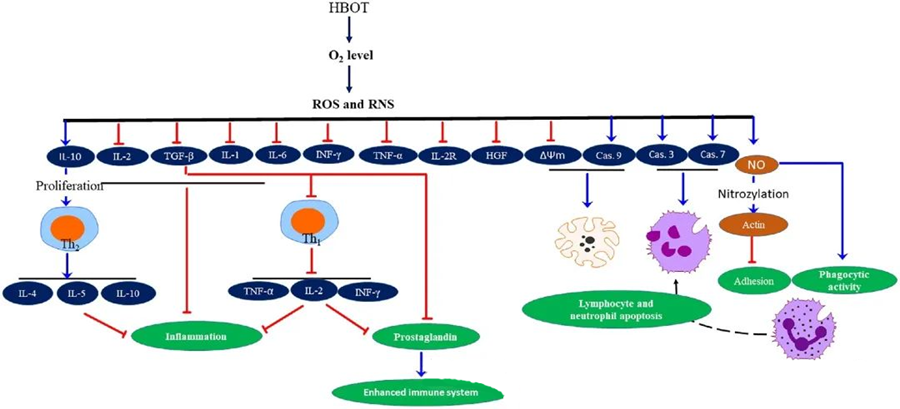
Hiperbarik oksijen tedavisinin anti-enflamatuar özellikleriHiperbarik oksijen tedavisinin (HBOT), doku hasarını hafifletmede ve enfeksiyon ilerlemesini baskılamada çok önemli olduğu belgelenmiştir. HBOT, sitokinlerin ve diğer inflamatuar düzenleyicilerin ekspresyonunu önemli ölçüde etkileyerek bağışıklık yanıtını etkiler. Çeşitli deneysel sistemlerde, HBOT sonrası gen ekspresyonunda ve protein üretiminde, büyüme faktörlerini ve sitokinleri ya yukarı ya da aşağı yönde düzenleyen farklı değişiklikler gözlemlenmiştir.
Hiperbarik oksijen tedavisi (HBOT) sürecinde, artan O₂ seviyeleri, pro-enflamatuar medyatörlerin salınımını baskılamak ve lenfosit ve nötrofil apoptozunu teşvik etmek gibi bir dizi hücresel yanıtı tetikler. Toplu olarak, bu eylemler bağışıklık sisteminin antimikrobiyal mekanizmalarını güçlendirerek enfeksiyonların iyileşmesini kolaylaştırır.
Dahası, çalışmalar, hiperbarik oksijen tedavisi (HBOT) sırasında artan O₂ seviyelerinin, interferon-gama (IFN-γ), interlökin-1 (IL-1) ve interlökin-6 (IL-6) dahil olmak üzere pro-enflamatuar sitokinlerin ekspresyonunu azaltabileceğini öne sürmektedir. Bu değişiklikler ayrıca CD4:CD8 T hücre oranının düşürülmesini ve diğer çözünür reseptörlerin modüle edilmesini de içerir ve sonuç olarak enflamasyonu önlemek ve iyileşmeyi desteklemek için çok önemli olan interlökin-10 (IL-10) seviyelerini yükseltir.
Hiperbarik oksijen tedavisinin (HBOT) antimikrobiyal aktiviteleri karmaşık biyolojik mekanizmalarla iç içe geçmiştir. Hem süperoksit hem de yüksek basıncın, HBOT kaynaklı antibakteriyel aktiviteyi ve nötrofil apoptozunu tutarsız bir şekilde desteklediği bildirilmiştir. HBOT sonrasında, oksijen seviyelerinde belirgin bir artış, bağışıklık tepkisinin temel bir bileşeni olan nötrofillerin bakterisidal yeteneklerini artırır. Ayrıca, HBOT, nötrofiller üzerindeki β-integrinlerin endotel hücrelerindeki hücreler arası yapışma molekülleri (ICAM) ile etkileşimi yoluyla gerçekleşen nötrofil yapışmasını baskılar. HBOT, nitrik oksit (NO) aracılı bir süreç yoluyla nötrofil β-2 integrin (Mac-1, CD11b/CD18) aktivitesini inhibe ederek nötrofillerin enfeksiyon bölgesine göçüne katkıda bulunur.
Nötrofillerin patojenleri etkili bir şekilde fagositoz edebilmesi için sitoskeletin hassas bir şekilde yeniden düzenlenmesi gereklidir. Aktinin S-nitrosilasyonunun aktin polimerizasyonunu uyardığı ve potansiyel olarak HBOT ön tedavisi sonrasında nötrofillerin fagositoz aktivitesini kolaylaştırdığı gösterilmiştir. Dahası, HBOT, mitokondriyal yollar aracılığıyla insan T hücre hatlarında apoptozu teşvik eder ve HBOT sonrası hızlanmış lenfosit ölümü bildirilmiştir. Kaspaz-8'i etkilemeden kaspaz-9'u bloke etmek, HBOT'nin immünomodülatör etkilerini göstermiştir.
Hiperbarik Oksijen Tedavisinin Antimikrobiyal Ajanlarla Sinerjik Etkileri
Klinik uygulamalarda, HBOT enfeksiyonlarla etkili bir şekilde mücadele etmek için sıklıkla antibiyotiklerle birlikte kullanılır. HBOT sırasında elde edilen hiperoksik durum, bazı antibiyotik ajanların etkinliğini etkileyebilir. Araştırmalar, β-laktamlar, florokinolonlar ve aminoglikozitler gibi spesifik bakterisidal ilaçların yalnızca doğal mekanizmalar yoluyla değil, aynı zamanda kısmen bakterilerin aerobik metabolizmasına da bağlı olarak etki gösterdiğini öne sürmektedir. Bu nedenle, antibiyotiklerin terapötik etkilerini değerlendirirken oksijenin varlığı ve patojenlerin metabolik özellikleri çok önemlidir.
Önemli kanıtlar, düşük oksijen seviyelerinin Pseudomonas aeruginosa'nın piperasilin/tazobaktama karşı direncini artırabileceğini ve düşük oksijenli bir ortamın Enterobacter cloacae'nin azitromisine karşı direncini de artırdığını göstermiştir. Tersine, bazı hipoksik koşullar bakterilerin tetrasiklin antibiyotiklerine duyarlılığını artırabilir. Hiperbarik oksijen tedavisi (HBOT), aerobik metabolizmayı uyararak ve hipoksik enfekte dokuları yeniden oksijenlendirerek, patojenlerin antibiyotiklere duyarlılığını artırarak, uygulanabilir bir yardımcı tedavi yöntemi olarak hizmet vermektedir.
Klinik öncesi çalışmalarda, günde iki kez 8 saat boyunca 280 kPa basınçta uygulanan hiperbarik oksijen tedavisi (HBOT) ile tobramisin (20 mg/kg/gün) kombinasyonunun, Staphylococcus aureus enfeksiyöz endokarditinde bakteri yükünü önemli ölçüde azalttığı gösterilmiştir. Bu, HBOT'nin yardımcı bir tedavi olarak potansiyelini ortaya koymaktadır. Daha ileri araştırmalar, 37°C ve 3 ATA basınç altında 5 saat boyunca uygulanan HBOT'nin, makrofaj enfeksiyonlu Pseudomonas aeruginosa'ya karşı imipenem'in etkilerini önemli ölçüde artırdığını göstermiştir. Ek olarak, HBOT'nin sefazolin ile birlikte uygulanmasının, hayvan modellerinde Staphylococcus aureus osteomiyelitinin tedavisinde sefazolin tek başına kullanımına göre daha etkili olduğu bulunmuştur.
Hiperbarik oksijen tedavisi (HBOT), özellikle 90 dakikalık maruz kalmanın ardından, siprofloksasinin Pseudomonas aeruginosa biyofilmlerine karşı bakterisidal etkisini önemli ölçüde artırır. Bu artış, endojen reaktif oksijen türlerinin (ROS) oluşumuna bağlanır ve peroksidaz eksikliği olan mutantlarda daha yüksek hassasiyet gösterir.
Metisiline dirençli Staphylococcus aureus (MRSA) kaynaklı plörit modellerinde, vankomisin, teikoplanin ve linezolidin hiperbarik oksijen tedavisi (HBOT) ile birlikte kullanımının MRSA'ya karşı etkinliği önemli ölçüde artırdığı gösterilmiştir. Diyabetik ayak enfeksiyonları (DFI) ve cerrahi bölge enfeksiyonları (SSI) gibi şiddetli anaerobik ve polimikrobiyal enfeksiyonların tedavisinde yaygın olarak kullanılan bir antibiyotik olan metronidazol, anaerobik koşullar altında daha yüksek antimikrobiyal etkinlik göstermiştir. HBOT'nin metronidazol ile birlikte kullanımının sinerjik antibakteriyel etkilerinin hem in vivo hem de in vitro ortamlarda araştırılması için gelecekteki çalışmalar gereklidir.
Hiperbarik Oksijen Tedavisinin Dirençli Bakteriler Üzerindeki Antimikrobiyal Etkinliği
Dirençli suşların evrimi ve yayılmasıyla birlikte, geleneksel antibiyotikler zamanla etkinliklerini kaybederler. Dahası, HBOT, çoklu ilaç dirençli patojenlerin neden olduğu enfeksiyonların tedavisinde ve önlenmesinde hayati önem taşıyabilir ve antibiyotik tedavilerinin başarısız olduğu durumlarda kritik bir strateji olarak hizmet edebilir. Çok sayıda çalışma, HBOT'nin klinik olarak önemli dirençli bakteriler üzerindeki önemli bakterisidal etkilerini bildirmiştir. Örneğin, 2 ATM'de 90 dakikalık bir HBOT seansı, MRSA'nın büyümesini önemli ölçüde azaltmıştır. Ek olarak, oran modellerinde, HBOT, MRSA enfeksiyonlarına karşı çeşitli antibiyotiklerin antibakteriyel etkilerini artırmıştır. Raporlar, HBOT'nin herhangi bir ek antibiyotiğe gerek kalmadan OXA-48 üreten Klebsiella pneumoniae'nin neden olduğu osteomiyelit tedavisinde etkili olduğunu doğrulamıştır.
Özetle, hiperbarik oksijen tedavisi, enfeksiyon kontrolüne yönelik çok yönlü bir yaklaşım olup, bağışıklık yanıtını güçlendirirken mevcut antimikrobiyal ajanların etkinliğini de artırmaktadır. Kapsamlı araştırma ve geliştirme çalışmalarıyla, antibiyotik direncinin etkilerini azaltma potansiyeline sahip olup, bakteriyel enfeksiyonlara karşı süregelen mücadelede umut vaat etmektedir.
Yayın tarihi: 28 Şubat 2025

