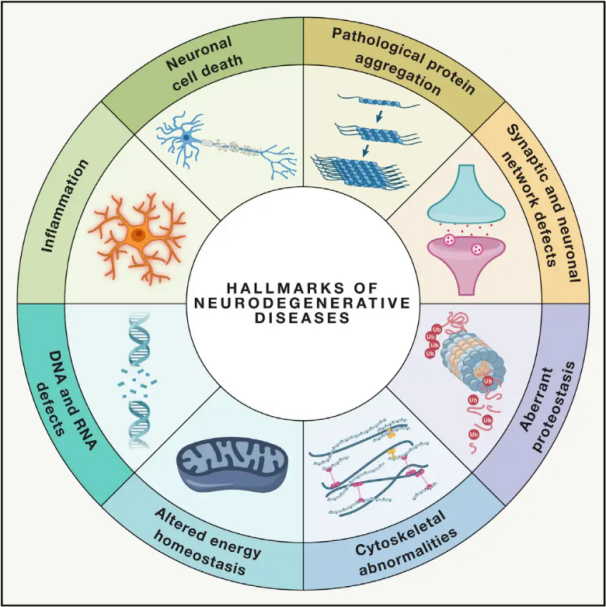
Nörodejeneratif hastalıklarNörodejeneratif hastalıklar (NDD'ler), beyin veya omurilik içindeki belirli hassas nöronal popülasyonların ilerleyici veya kalıcı kaybı ile karakterize edilir. NDD'lerin sınıflandırılması, nörodejenerasyonun anatomik dağılımı (ekstrapiramidal bozukluklar, frontotemporal dejenerasyon veya spinoserebellar ataksiler gibi), birincil moleküler anormallikler (amiloid-β, prionlar, tau veya α-sinüklein gibi) veya başlıca klinik özellikler (Parkinson hastalığı, amiyotrofik lateral skleroz ve demans gibi) dahil olmak üzere çeşitli kriterlere dayanabilir. Sınıflandırma ve semptom sunumundaki bu farklılıklara rağmen, Parkinson Hastalığı (PD), Amiyotrofik Lateral Skleroz (ALS) ve Alzheimer Hastalığı (AD) gibi bozukluklar, nöronal disfonksiyona ve nihayetinde hücre ölümüne yol açan ortak altta yatan süreçleri paylaşmaktadır.
Dünya çapında milyonlarca insanı etkileyen nörodejeneratif hastalıklar (NDD'ler) ile ilgili olarak, Dünya Sağlık Örgütü, 2040 yılına kadar bu hastalıkların gelişmiş ülkelerde ikinci en önde gelen ölüm nedeni olacağını tahmin etmektedir. Belirli hastalıklarla ilişkili semptomları hafifletmek ve yönetmek için çeşitli tedaviler mevcut olsa da, bu durumların ilerlemesini yavaşlatacak veya iyileştirecek etkili yöntemler hala bulunamamıştır. Son çalışmalar, tedavi paradigmalarında sadece semptomatik yönetimden, daha fazla bozulmayı önlemek için hücre koruyucu mekanizmaların kullanılmasına doğru bir kayma olduğunu göstermektedir. Kapsamlı kanıtlar, oksidatif stres ve inflamasyonun nörodejenerasyonda önemli roller oynadığını ve bu mekanizmaları hücresel koruma için kritik hedefler olarak konumlandırdığını göstermektedir. Son yıllarda, temel ve klinik araştırmalar, nörodejeneratif hastalıkların tedavisinde Hiperbarik Oksijen Tedavisinin (HBOT) potansiyelini ortaya koymuştur.
Hiperbarik Oksijen Tedavisini (HBOT) Anlamak
Hiperbarik oksijen tedavisi (HBOT) genellikle, tedavi edilen özel duruma bağlı olarak birden fazla seans gerektirebilecek şekilde, 90-120 dakika süreyle mutlak atmosfer basıncının (ATA) - deniz seviyesindeki basıncın - üzerine çıkarılmasını içerir. Artırılmış hava basıncı, hücrelere oksijen iletimini iyileştirir; bu da kök hücre çoğalmasını uyarır ve belirli büyüme faktörleri aracılığıyla gerçekleşen iyileşme süreçlerini hızlandırır.
Başlangıçta, hiperbarik oksijen tedavisi (HBOT) uygulaması, dokulardaki yüksek oksijen seviyelerinin faydalarının yanı sıra, gaz kabarcıklarının basınca bağlı olarak azalmasını öne süren Boyle-Marriott yasasına dayanıyordu. Sualtı ve Hiperbarik Tıp Derneği tarafından listelenenler arasında nekrotik dokular, radyasyon hasarları, travma, yanıklar, kompartman sendromu ve gazlı gangren gibi HBOT'nin ürettiği hiperoksik durumdan fayda gördüğü bilinen bir dizi patoloji bulunmaktadır. Özellikle, HBOT'nin kolit ve sepsis gibi çeşitli inflamatuar veya enfeksiyonlu hastalık modellerinde yardımcı bir tedavi olarak da etkili olduğu gösterilmiştir. Anti-inflamatuar ve oksidatif mekanizmaları göz önüne alındığında, HBOT nörodejeneratif hastalıklar için önemli bir tedavi yolu potansiyeli sunmaktadır.
Nörodejeneratif Hastalıklarda Hiperbarik Oksijen Tedavisinin Klinik Öncesi Çalışmaları: 3×Tg Fare Modelinden Elde Edilen Bulgular
Önemli çalışmalardan biriAlzheimer hastalığının (AD) 3×Tg fare modeline odaklanan bu çalışma, HBOT'nin bilişsel eksiklikleri iyileştirmedeki terapötik potansiyelini ortaya koydu. Araştırmada, kontrol grubu olarak kullanılan 14 aylık erkek C57BL/6 farelerle karşılaştırılan 17 aylık erkek 3×Tg fareler kullanıldı. Çalışma, HBOT'nin sadece bilişsel işlevi iyileştirmekle kalmayıp, aynı zamanda iltihabı, plak yükünü ve AD patolojisiyle ilişkili kritik bir süreç olan Tau fosforilasyonunu da önemli ölçüde azalttığını gösterdi.
Hiperbarik oksijen tedavisinin (HBOT) koruyucu etkileri, nöroinflamasyonun azalmasına bağlanmıştır. Bu durum, mikroglia çoğalmasının, astrogliyozun ve proinflamatuar sitokinlerin salgılanmasının azalmasıyla kanıtlanmıştır. Bu bulgular, HBOT'nin bilişsel performansı artırırken aynı zamanda Alzheimer hastalığıyla ilişkili nöroinflamatuar süreçleri hafifletmedeki ikili rolünü vurgulamaktadır.
Başka bir preklinik modelde, HBOT'nin nöronal fonksiyon ve motor yetenekler üzerindeki koruyucu mekanizmalarını değerlendirmek için 1-metil-4-fenil-1,2,3,6-tetrahidropiridin (MPTP) fareleri kullanılmıştır. Sonuçlar, HBOT'nin bu farelerde motor aktiviteyi ve kavrama gücünü artırdığını ve bunun da özellikle SIRT-1, PGC-1α ve TFAM aktivasyonu yoluyla mitokondriyal biyogenez sinyallemesindeki artışla ilişkili olduğunu göstermiştir. Bu, mitokondriyal fonksiyonun HBOT'nin nöroprotektif etkilerindeki önemli rolünü vurgulamaktadır.
Nörodejeneratif Hastalıklarda Hiperbarik Oksijen Tedavisinin Mekanizmaları
Nörodejeneratif hastalıklar için hiperbarik oksijen tedavisinin (HBOT) kullanımının temel prensibi, azalmış oksijen tedariki ile nörodejeneratif değişikliklere yatkınlık arasındaki ilişkiye dayanmaktadır. Hipoksiye duyarlı faktör-1 (HIF-1), hücrelerin düşük oksijen gerilimine adaptasyonunu sağlayan bir transkripsiyon faktörü olarak merkezi bir rol oynar ve Alzheimer hastalığı, Parkinson hastalığı, Huntington hastalığı ve ALS dahil olmak üzere çeşitli nörodejeneratif hastalıklarda rol oynadığı için önemli bir ilaç hedefi olarak öne çıkmaktadır.
Yaş, birçok nörodejeneratif bozukluk için önemli bir risk faktörü olduğundan, hiperbarik oksijen tedavisinin (HBOT) yaşlanma nörobiyolojisi üzerindeki etkisini araştırmak hayati önem taşımaktadır. Yapılan çalışmalar, hiperbarik oksijen tedavisinin (HBOT) sağlıklı yaşlı bireylerde yaşa bağlı bilişsel bozuklukları iyileştirebileceğini göstermiştir.Ek olarak, önemli hafıza bozuklukları olan yaşlı hastalarda HBOT'ye maruz kalmanın ardından bilişsel iyileşmeler ve beyin kan akışında artış gözlemlenmiştir.
1. Hiperbarik Oksijen Tedavisinin Enflamasyon ve Oksidatif Stres Üzerindeki Etkisi
Hiperbarik oksijen tedavisi (HBOT), şiddetli beyin fonksiyon bozukluğu olan hastalarda nöroinflamasyonu hafifletme yeteneğini göstermiştir. İltihap önleyici sitokinleri (IL-1β, IL-12, TNFα ve IFNγ gibi) baskılarken, iltihap karşıtı sitokinleri (IL-10 gibi) artırma kapasitesine sahiptir. Bazı araştırmacılar, HBOT tarafından üretilen reaktif oksijen türlerinin (ROS) tedavinin çeşitli faydalı etkilerine aracılık ettiğini öne sürmektedir. Sonuç olarak, basınca bağlı kabarcık azaltıcı etkisi ve yüksek doku oksijen doygunluğuna ulaşmasının yanı sıra, HBOT ile bağlantılı olumlu sonuçlar kısmen üretilen ROS'un fizyolojik rollerine bağlıdır.
2. Hiperbarik Oksijen Tedavisinin Apoptotik Hücre Ölümü ve Nöroproteksiyon Üzerindeki Etkileri
Araştırmalar, hiperbarik oksijen tedavisinin (HBOT) hipokampal p38 mitojenle aktive olan protein kinazın (MAPK) fosforilasyonunu azaltabileceğini, bunun sonucunda bilişsel işlevleri iyileştirebileceğini ve hipokampal hasarı azaltabileceğini göstermiştir. Hem tek başına HBOT'nin hem de Ginkgo biloba özütü ile kombinasyonunun, Bax ekspresyonunu ve kaspaz-9/3 aktivitesini düşürdüğü ve bunun sonucunda aβ25-35 ile indüklenen kemirgen modellerinde apoptoz oranlarında azalmaya yol açtığı bulunmuştur. Ayrıca, başka bir çalışma, HBOT ön koşullandırmasının serebral iskemiye karşı tolerans oluşturduğunu, mekanizmaların artmış SIRT1 ekspresyonu, artmış B-hücreli lenfoma 2 (Bcl-2) seviyeleri ve azalmış aktif kaspaz-3 içerdiğini göstermiş ve HBOT'nin nöroprotektif ve anti-apoptotik özelliklerinin altını çizmiştir.
3. Hiperbarik Oksijen Tedavisinin Dolaşım Üzerindeki Etkisi veNörogenez
Hiperbarik oksijen tedavisine (HBOT) maruz kalmanın, kan-beyin bariyeri geçirgenliğini artırma, anjiyogenezi teşvik etme ve ödemi azaltma gibi kranial vasküler sistem üzerinde birçok etkiye sahip olduğu gösterilmiştir. HBOT, dokulara artan oksijen tedariki sağlamanın yanı sıra, başka faydalar da sunmaktadır.damar oluşumunu desteklerVasküler endotelyal büyüme faktörü gibi transkripsiyon faktörlerini aktive ederek ve nöral kök hücrelerin çoğalmasını uyararak.
4. Hiperbarik Oksijen Tedavisinin Epigenetik Etkileri
Yapılan çalışmalar, insan mikrovasküler endotel hücrelerinin (HMEC-1) hiperbarik oksijene maruz kalmasının, hem yukarı yönlü hem de aşağı yönlü ifadeler de dahil olmak üzere 8.101 geni önemli ölçüde düzenlediğini ve antioksidan yanıt yollarıyla ilişkili gen ifadesinde bir artışa işaret ettiğini ortaya koymuştur.
Çözüm
Hiperbarik oksijen tedavisi (HBOT) kullanımı zaman içinde önemli ilerlemeler kaydetmiş ve klinik uygulamada erişilebilirliğini, güvenilirliğini ve güvenliğini kanıtlamıştır. HBOT, nörogelişimsel bozukluklar (NDD'ler) için ruhsat dışı bir tedavi olarak araştırılmış ve bazı araştırmalar yapılmış olsa da, bu durumların tedavisinde HBOT uygulamalarını standartlaştırmak için titiz çalışmalara acil ihtiyaç duyulmaktadır. Optimal tedavi sıklıklarını belirlemek ve hastalar için faydalı etkilerin kapsamını değerlendirmek için daha fazla araştırma şarttır.
Özetle, hiperbarik oksijen tedavisi ile nörodejeneratif hastalıkların kesişim noktası, tedavi olanakları açısından umut vadeden bir alanı ortaya koymakta olup, klinik ortamlarda sürekli araştırma ve doğrulama gerektirmektedir.
Yayın tarihi: 16 Mayıs 2025

